省重点实验室高冠斌教授和孙涛垒教授在纳米颗粒的核心/配体界面锚结构有效抑制 Aβ 和Amylin蛋白纤维化取得了新的研究进展
省重点实验室高冠斌教授和孙涛垒教授在纳米颗粒的核心/配体界面锚结构有效抑制 Aβ 和Amylin蛋白纤维化取得了新的研究进展。发表研究成果“Engineering core/ligands interfacial anchors of nanoparticles for efficiently inhibiting both Aβ and Amylin fibrillization”发表在国际知名期刊《Small》(IF=13.3)上。材料学院硕士研究生邓昱周为第一作者,孙涛垒教授和高冠斌教授为共同通讯作者。
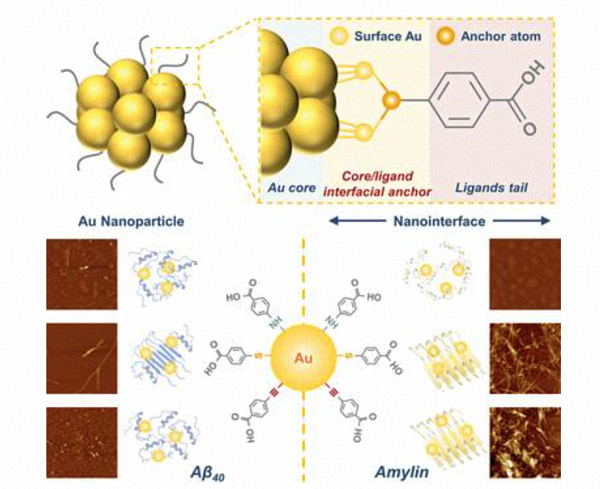
人工纳米伴侣结构的精确构建对于精确调控蛋白质构象转变、促进蛋白质病的有效治疗至关重要。然而,纳米伴侣的配体锚结构如何影响蛋白质的空间构象变化仍不清楚,限制了高效纳米伴侣的发展。在本研究中,合成了三种具有不同核心/配体界面锚定结构的金纳米颗粒(Au─NH─R、Au─S─R、Au─C≡C─R,R=苯甲酸):这是研究界面锚定对 Aβ 和Amylin蛋白纤维化影响的理想模型。计算结果表明,不同的界面锚结构在纳米界面上赋予了不同的静电势分布和金纳米粒子的核心/配体键合强度,从而导致与淀粉样肽的不同相互作用。实验结果表明,三种不同锚结构的AuNPs优先结合表现出对Aβ 40 蛋白纤维化的位点特异性抑制作用。对于Amylin,氨基锚定的金纳米粒子表现出对胰岛淀粉样多肽上多个位点的强吸附性,并有效抑制纤维化。相反,硫醇和炔烃锚定的 AuNPs 吸附在Amylin的头部区域,促进折叠和纤维化。这项研究不仅为纳米材料的核心/配体界面锚定如何诱导淀粉样肽的空间构象变化提供了分子见解,而且还为精确设计人工伴侣的纳米界面以调节蛋白质的构象转变提供了指导。
文章信息:Yuzhou Deng, Guanbin Gao*, Liangchong Yu, Zijun Zhang, Bin Zhang, Hu Li, Xinyu Zhang, Lei Shen, Taolei Sun*. Engineering core/ligands interfacial anchors of nanoparticles for efficiently inhibiting both Aβ and Amylin fibrillization[J]. Small,2024, DOI: 10.1002/smll.202

